我院朱志教授课题组在靶向蛋白降解方面取得新进展,相关成果以“Aptamer-LYTACs for Targeted Degradation of Extracellular and Membrane Proteins.”为题近日发表于Angew. Chem. Int. Ed.(DOI: 10.1002/anie.202218106)。
靶向蛋白降解技术通过以高度选择性和有效的方式触发蛋白质降解来控制蛋白质命运的能力,为“不可成药”蛋白的药物研发提供了新方向。其主要是利用细胞内天然存在的两大蛋白降解系统,即泛素化-蛋白酶体系统与溶酶体降解途径,来实现对疾病相关蛋白的特异、高效降解,从而达到疾病治疗的效果。溶酶体降解技术(LYTACs)能够参与细胞表面膜蛋白和胞外蛋白的降解。但是目前基于低聚糖和抗体的LYTACs化学合成步骤复杂,此外抗体还存在免疫原性、分子量大等缺点。如何实现合成步骤简单,组织特异性降解靶蛋白,是LYTACs降解靶向蛋白亟需解决的问题。
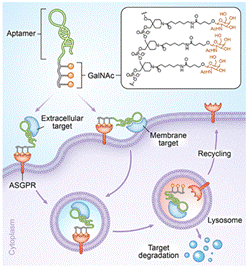
针对这一难题,我们提出了基于核酸适体和寡糖的双功能溶酶体靶向嵌合体(Apt-LYTACs),实现组织特异性的胞外蛋白和膜蛋白的降解。利用DNA固相化学合成,将三聚乙酰半乳糖胺(GalNAc)修饰于核酸适体序列的末端。嵌合体通过GalNAc结合肝脏细胞表面特异性表达的去唾液酸糖蛋白受体(ASGPR)、核酸适体特异性识别靶蛋白,从而将靶蛋白带入到溶酶体中,实现靶蛋白的降解。我们验证了该嵌合体可实现肝癌细胞HepG2对胞外蛋白链霉亲和素(SA)和血小板衍生因子(PDGF)的组织特异性内吞,并发生溶酶体依赖的蛋白降解。通过合成含酪蛋白激酶7(PTK7)核酸适体的嵌合体,进一步实现了HepG2细胞中膜蛋白PTK7的降解。该工作首次提出基于核酸适体和寡糖的双功能溶酶体靶向嵌合体,具有免疫原性低、分子量小、合成简单且精确可控等优点,为靶向蛋白降解提供了一种新策略。
该工作在我院朱志教授指导下完成。我院2020级硕士生吴昱奇为论文第一作者。研究工作得到了国家重点研发计划(2021YFA0909400、2019YFA0905800)、国家自然科学基金(21974113、21735004、21927806)、中央高校基本科研基金(20720210001、20720220005)、育苗基金(NFFTBS, J1310024)等项目的资助。
论文链接:https://doi.org/10.1002/anie.202218106
