近日,我院宋彦龄教授团队提出了一种针对唾液酸结合免疫球蛋白样凝集素-15(Siglec-15)的新型免疫治疗策略。相关研究成果以“Aptamer-Assisted Blockade of the Immune Suppressor Sialic Acid-Binding Immunoglobulin-Like Lectin-15 for Cancer Immunotherapy”为题发表于Angewandte Chemie International Edition杂志 (Doi:10.1002/anie.202312609)。
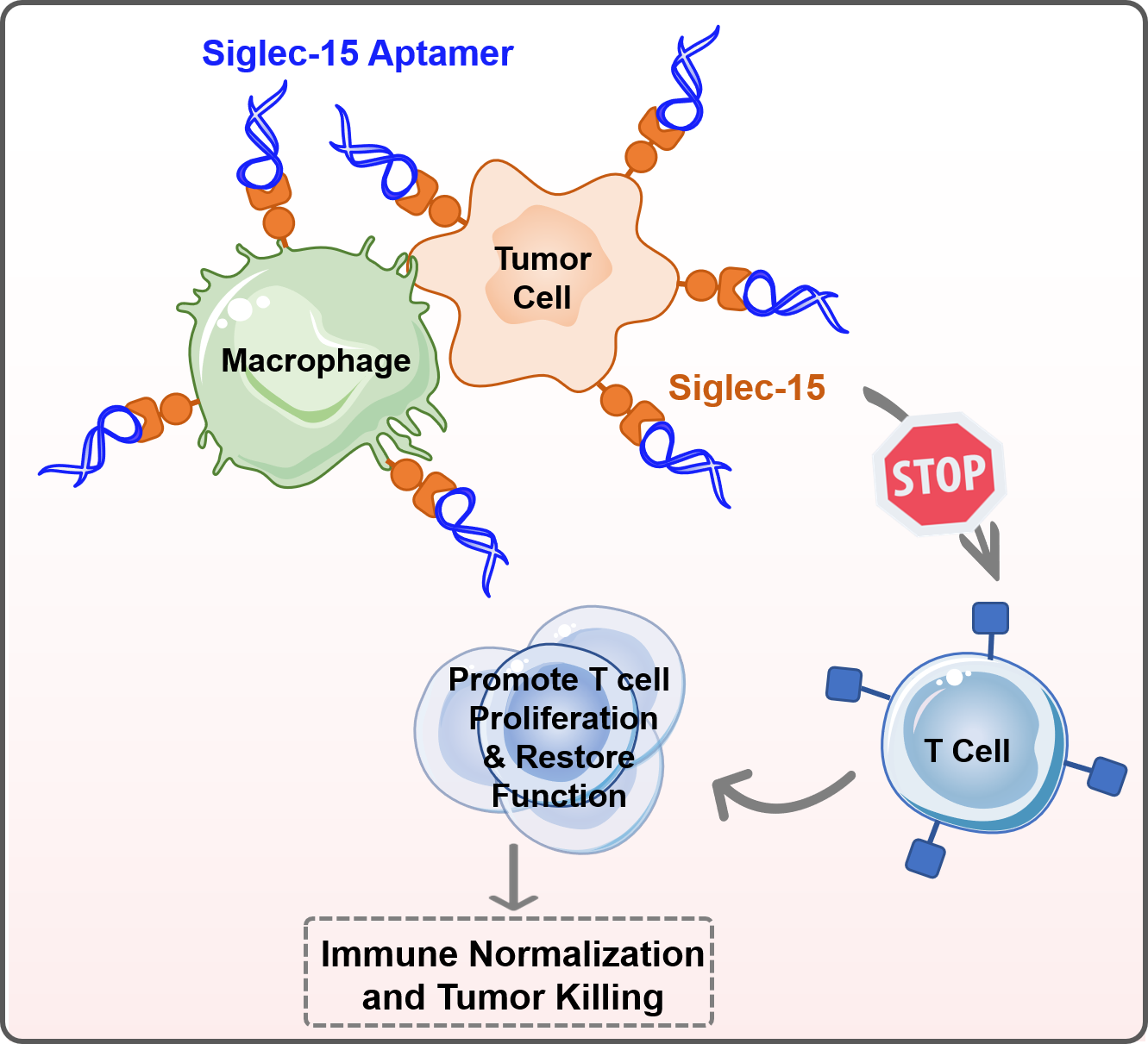
近年来,免疫检查点抑制剂疗法已显著改变了多种癌症的治疗及预后。这种疗法通常通过抗体靶向结合肿瘤细胞上的特定免疫检查点,从而解除对T细胞激活的抑制,激发肿瘤微环境中的抗肿瘤免疫反应。特别是,针对程序性死亡受体1/程序性细胞死亡配体1(PD-1/PD-L1)的阻断策略,在治疗多种癌症方面展现出显著的临床潜力。然而,肿瘤的高度异质性和复杂的免疫逃逸机制限制了这些疗法的总体效果,通常临床响应率低于30%,并伴随着适应性抗药性的发展。鉴于这些挑战,探索新的免疫检查点并开发创新免疫治疗疗法显得尤为重要。近期,著名免疫学家陈列平教授等报道了一种新的免疫检查点——Siglec-15,它在多种癌细胞和肿瘤相关巨噬细胞中表达上调,且其表达与PD-L1表达互斥,暗示着两者可能通过不同但相互补充的机制介导免疫抑制。
基于这一发现,我院宋彦龄研究团队提出了一种新型的核酸适体介导免疫检查点阻断(Ap-ICB)策略,旨在阻断免疫检查点Siglec-15与T细胞互作,从而激活T细胞。与传统抗体疗法相比,这种单链核酸适体由于分子量更小,具有更好的组织渗透性和较低的免疫原性。此外,适配体的小尺寸和缺乏Fc片段降低了它们引发免疫相关副作用的风险。通过从头定向进化,团队鉴定出一种高亲和力的单链DNA适体WXY3,它能特异性地结合Siglec-15,且平衡解离常数在纳摩尔级,为精准治疗提供了可能。体外实验表明,WXY3序列能够解除Siglec-15对T细胞的增值抑制作用,恢复T活性。在小鼠模型中,WXY3序列显著抑制了肿瘤生长和转移;此外,单细胞RNA测序技术揭示了WXY3治疗后肿瘤微环境中巨噬细胞和T细胞功能的增强。为了进一步提升抗肿瘤效果,还开发了基于WXY3的球形核酸(Ap-SNA),多价结合和空间匹配阻碍进一步增强了对Siglec-15介导免疫抑制的阻断效果,展现出更强的抗肿瘤活性。综上,针对免疫检查点Siglec-15的Ap-ICB策略,特别是WXY3适体及其衍生物Ap-SNA,为癌症免疫治疗提供了一种潜在的新途径,特别是对于那些对传统PD-1/PD-L1疗法有抵抗性的病例。
我院2019级博士研究生吴秋月(现beat365官方网站博士后)为论文的第一作者,研究生魏心语(已毕业)为共同第一作者。该工作在我院宋彦龄教授指导下完成。研究工作主要得到了国家自然科学基金(22022409,92269114和22293031)等项目的支持。
论文链接:https://onlinelibrary.wiley.com/doi/abs/10.1002/anie.202312609
